AP化學(xué)考試課程介紹及備考建議
2017/9/22 14:03:17來源:新航道作者:新航道
摘要:AP chem考試形式:第一部分為60道選擇題,耗時90min,主要考察AP chem所要求掌握的知識原理及應(yīng)用。第二部分為簡答題,其中3道長簡答和4道短簡答,內(nèi)容涉及實驗設(shè)計、數(shù)據(jù)分析、觀察并解釋現(xiàn)象等。
關(guān)于AP考試
AP課程涵蓋30多門學(xué)科,難度與同等大學(xué)課程相當(dāng),在全世界范圍內(nèi)有60多個國家多大1000多所高校承認AP的考試成績并提供想對等的學(xué)分,為還處在高中階段的學(xué)有余力的學(xué)生提供了提前獲得學(xué)分的機會。
關(guān)于AP chem 考試
相比于國內(nèi)高中化學(xué),AP chem在深度和廣度上都有不少提升,所以如果你是國內(nèi)普通全日制高中生且打算考取AP化學(xué),那么應(yīng)該做好下大力氣的準(zhǔn)備。而如果你是國際學(xué)校的學(xué)生,基本要求就是按照學(xué)校的課程要求完成平時的課程練習(xí)并在考前留出足夠多的時間來進行強化和復(fù)習(xí)。
AP chem考試形式
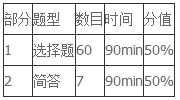
另外,在簡答題部分可以使用計算器;在全部兩個考試部分中都提供元素周期表、常用公式以及常用常數(shù)。
AP選擇題部分由機器判卷而free response 部分由人工判卷,最后二者結(jié)合形成1-5分五檔。一般來講,5分對應(yīng)大學(xué)的A,4分對應(yīng)A-、B+、B,3分對應(yīng)B-、C+和C。其中低于3分的成績不被認為是有用的成績。
|
AP Score |
Qualification |
||||||||||||||||||||||||
|
5 |
Extremely well qualified |
||||||||||||||||||||||||
|
4 |
Well qualified |
||||||||||||||||||||||||
|
3 |
Qualified |
||||||||||||||||||||||||
|
2 |
Possibly qualified |
||||||||||||||||||||||||
|
1 |
No recommendation AP考試知識分布點
|
||||||||||||||||||||||||
更多相關(guān)的AP化學(xué)資料,請點擊:AP化學(xué)頻道。

請加新航道老師(微信號:shnc_2018)
百人留學(xué)備考群,名師答疑,助教監(jiān)督,分享最新資訊,領(lǐng)取獨家資料。掃碼免費加入
免費獲取資料
相關(guān)內(nèi)容
- 新航道分享:AP化學(xué)必考點- Thermochemistry
- 新航道分享:AP化學(xué)必考點 - Equilibrium
- 2017AP化學(xué)備考方案+考試大綱
- 新航道分享:AP化學(xué)必考點-Kineitics
- 十個不得的AP化學(xué)知識點問答
- 新航道名師分享75道經(jīng)典AP化學(xué)選擇題-第三章
- 新航道名師分享75道經(jīng)典AP化學(xué)選擇題-第二章
- 新航道名師分享75道經(jīng)典AP化學(xué)選擇題-第一章
- 官方發(fā)布AP化學(xué)真題及下載
- 新航道解析AP化學(xué)必考知識點 - Gas Law氣體定律
- 新航道解析AP化學(xué)必考點-Electronic configuration
- 美國AP考試的幾大作用
- AP化學(xué)的課程要求
熱報課程
- AP課程
| 班級名稱 | 班號 | 開課時間 | 人數(shù) | 學(xué)費 | 報名 |
|---|---|---|---|---|---|
| AP心理學(xué) | APPSY1901 | 2019/1/24 0:00:00 | 3-6人 | ¥24800.00 | 在線咨詢 |
| AP生物 | APBIO1801 | 2018/2/8 0:00:00 | 3-6人 | ¥15800.00 | 在線咨詢 |
| AP商務(wù)管理 | APCOM1801 | 2018/2/20 0:00:00 | 10-15人 | ¥6800.00 | 在線咨詢 |
| AP美國歷史 | APUSH1801 | 2018/2/20 0:00:00 | 10-15人 | ¥6800.00 | 在線咨詢 |
| AP力學(xué) | APPHM1702 | 2017-02-26/2017-04-23 | 10-15人 | ¥6800.00 | 在線咨詢 |
| AP世界歷史 | APWDH1901 | 2019/1/24 0:00:00 | 3-6人 | ¥24800.00 | 在線咨詢 |
免責(zé)聲明
1、如轉(zhuǎn)載本網(wǎng)原創(chuàng)文章,情表明出處
2、本網(wǎng)轉(zhuǎn)載媒體稿件旨在傳播更多有益信息,并不代表同意該觀點,本網(wǎng)不承擔(dān)稿件侵權(quán)行為的連帶責(zé)任;
3、如本網(wǎng)轉(zhuǎn)載稿、資料分享涉及版權(quán)等問題,請作者見稿后速與新航道聯(lián)系(電話:021-64380066),我們會第一時間刪除。
AP化學(xué)

AP化學(xué)考試課程介紹及備考建議
制作:每每
-
新航道課程
雅思培訓(xùn) 托福培訓(xùn) SAT培訓(xùn) ACT培訓(xùn) -
關(guān)于新航道
關(guān)于我們 師資力量 校區(qū)地址 人才招聘 在線咨詢 -
新航道VIP培訓(xùn)
雅思一對一 托福一對一 SAT一對一 ACT一對一


旗艦校區(qū):上海徐匯區(qū)文定路209號寶地文定商務(wù)中心1樓 乘車路線:地鐵1/4號線上海體育館、3/9號線宜山路站、11號線上海游泳館站
電話:4008-125-888
版權(quán)所有:上海胡雅思投資管理有限公司 滬ICP備11042568號-1





